こちらでは、患者さんをはじめとする一般の方々も含めて、できる限りわかりやすい表現で、本研究をご紹介させていただきます。
「オピオイド不応性がん関連神経障害性疼痛を対象に、14日間のデュロキセチンの有効性および安全性をプレガバリンと比較する、国際多施設共同二重盲検用量漸増第III相ランダム化比較試験」の臨床試験※についての説明です。
今回ご説明するのは、臨床試験の中でも「医師主導臨床試験」という研究のひとつです。これは企業が中心となって行う「治験」とは違い、医師が研究者として主体的に行うものです。
※ 臨床試験とは?
病気の予防方法、診断方法及び治療方法の改善、患者さんの生活の質の向上などを目的として、患者さんのご協力を得て行われる研究のことです。現在行われている診断や治療の方法も長い時間をかけて研究され、改善されてきました。医学は常に発展していますが、未だ診断法や治療法が確立していない病気もたくさんあります。また、治療方法があったとしても、その効果に限界がある場合や、副作用が問題となることもあります。そのため、患者さんのご理解とご協力を頂いた上で、より良い医療のための試験(研究)を行う必要があります。
この臨床試験を実施するにあたって、患者さんの人権や安全に配慮されているかどうか、医学の発展に役立つかどうかについて、厚生労働大臣が「認定臨床研究審査委員会」として認定した大阪市立大学医学部附属病院 臨床研究審査委員会で審査されました。また、臨床研究を行う際に従わなければならない「臨床研究法」に沿って計画された試験であることも審査されています。そして、この臨床試験は認定臨床研究審査委員会の承認を受け、各施設長の許可を得て、厚生労働大臣に実施計画の届出を行った上で実施しています。
審査を行った認定臨床研究審査委員会は下記のとおりです。
大阪市立大学医学部附属病院 臨床研究審査委員会
〒545-0051 大阪府大阪市阿倍野区旭町1-2-7 あべのメディックス6階
【担当部署】大阪市立大学医学部・附属病院運営本部 研究推進課
【電話番号】06-6645-3456 *担当部署
本試験に参加するかどうかは患者さんの自由です。たとえ試験への参加をお断りになっても、不利益が生じることはありません。また、試験に参加いただいた場合でも、途中でやめたいと思われたら、いつでもどのような理由でも不利益を受けることなくやめることができます。その場合であっても、私たちは患者さんにとって最善の治療を行います。
がんの痛みには、侵害受容性疼痛(体性痛・内臓痛)と神経障害性疼痛があります。
そのうち、侵害受容性疼痛には、NSAIDsやアセトアミノフェンと言われる、いわゆる通常の痛み止めや、オピオイド鎮痛薬(医療用麻薬)が有効です。
ただそれ以外に、難治性のがんの痛みの代表的な症状として、これらの薬剤だけでは効果が不十分である神経障害性疼痛(神経障害による痛み)があります。神経障害による痛みの治療には、薬物治療として、オピオイド鎮痛薬のほかに、鎮痛補助薬(抗うつ薬、抗けいれん薬など)と呼ばれる特殊な痛み止めが有効であることが知られており、ガイドラインにも記載されておりますが、いずれも根拠となる研究が不十分であり、エビデンス(科学的な根拠)が十分とは言えません。症状をやわらげるためには、さらなる研究により、痛みの治療の標準化が必要と考えます。
現在日本では、がんによる神経障害性疼痛の治療に抗けいれん薬(プレガバリンなど)や抗うつ薬(デュロキセチンなど)を使用することについてはガイドラインにも記載されておりますが、いずれも根拠となる研究が弱くエビデンス(科学的な根拠)が十分とは言えず、最新のWHOガイドラインでも、鎮痛補助薬の使用に関しては、臨床試験の実施が推奨されております。
そこで本試験は、非がんの神経障害性疼痛に対してはガバペンチノイド(プレガバリンやガバペンチン)よりも優れた効果を示しているにも関わらず、がん患者さんの神経障害性疼痛に対して、デュロキセチンの使用を支持する十分な根拠がまだ存在しないため、そのエビデンス(科学的根拠)を確立すべく計画させていただきました。
神経障害性疼痛で苦しんでいるがんの患者さんにご協力いただき、プレガバリンの内服もしくはデュロキセチンの内服による神経障害性疼痛の改善効果と副作用の種類と程度を調べることがこの試験の目的です。この試験の結果により、デュロキセチンの効果が明らかになれば、神経障害性疼痛患者さんの痛みに対して、治療の選択肢が広がることが期待されます。
この試験は、本院に外来通院中または入院加療中のがん患者さんで、神経障害性疼痛と診断された患者さんに参加していただいて実施します。
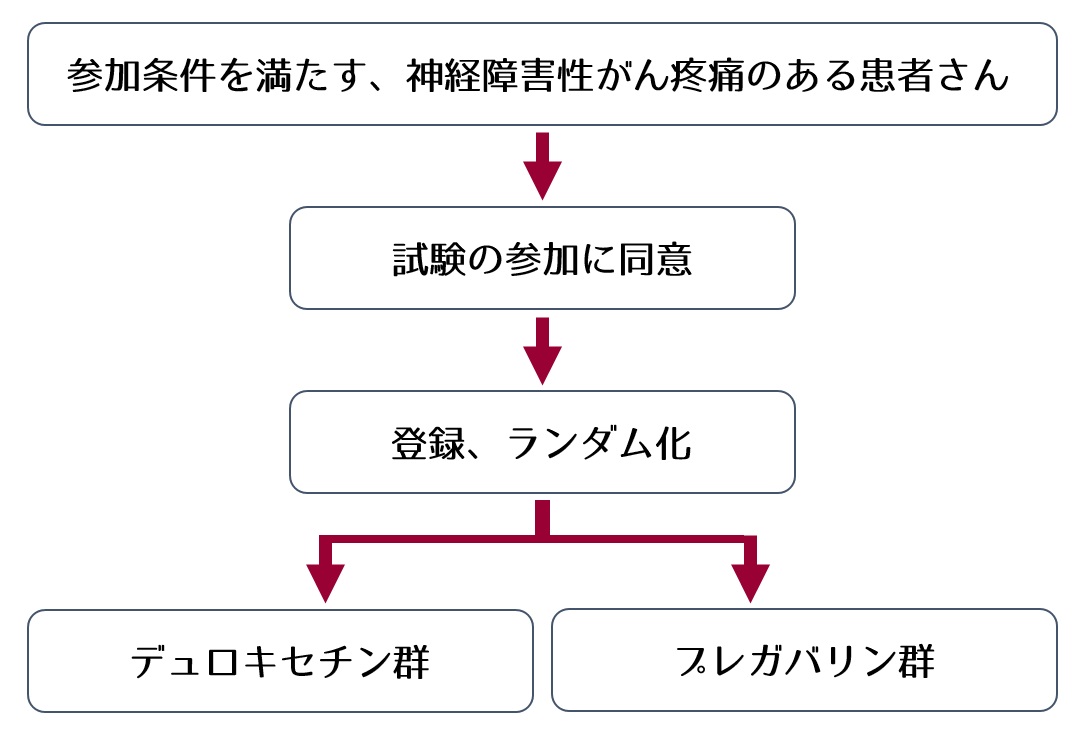
試験をできるだけ安全に行うため、この試験に参加していただく患者さんの条件が以下に設けられています。
| (1) | 本試験への参加にあたり十分な説明を受けた後、十分な理解の上、文書による同意をいただける方 |
| (2) | 同意をいただく時点で、年齢が20歳以上の方 |
| (3) | 神経障害性がん疼痛のある方 |
| (4) | 一定度以上の痛みのある方 |
| (1) | 化学療法に伴う痛みのある方 |
| (2) | 2週間以内にプレガバリンまたはデュロキセチンを使用中の方 |
| (3) | 妊娠中、授乳中、または妊娠している可能性のある方 |
| (4) | 肝臓や腎臓の機能に問題のある方 |
その他に参加をご遠慮いただくいくつかの条件がありますが、診察や検査の結果をよくみた上で担当医が判断します。詳しくは担当医が説明します。
この研究では、次のどちらかの薬剤の内服を、1日2回(朝と就寝時)、14日間(漸減期間を含むと最大21日間)行っていただきます。どちらの治療を行なうかはコンピューターが同じ確率で決めるため、担当医も患者さんも選ぶことはできません。
また、どちらの治療に決まったかは、担当医も患者さんも知ることはできません(「二重盲検」といいます)。これは、思い込みによる治療の効果の偏りを減らすために行われます。万が一、予期しない副作用が患者さんに発生した場合は、直ちに、どちらの薬剤かを服用していたかが開示され、適切な処置をいたします。
| 1-3日目 | デュロキセチン30mg1カプセル(朝)およびプラセボ1カプセル(就寝時) |
| 4-7日目 | デュロキセチン30mg1カプセル(朝)およびプラセボ1カプセル(就寝時) |
| 8-14日目 | デュロキセチン30mg1カプセルとプラセボ1カプセルの両方(2カプセル)を1日2回(朝と就寝時)服用します。14日目の朝、痛みを評価します。15日目以降はお薬をだんだん減らします(最大21日間内服していただきます)。 |
※プラセボとは偽薬とも呼ばれ、薬としての有効成分を含まないもので、今回の試験ではカプセルの中に乳糖を入れます。
| 1-3日目 | プレガバリン25mg1カプセルを1日2回(朝と就寝時) |
| 4-7日目 | プレガバリン75mg1カプセルを1日2回(朝と就寝時) |
| 8-14日目 | プレガバリン75mg 2カプセル(150mg)を1日2回(朝と就寝時)服用します。14日目の朝、痛みを評価します。15日目以降はお薬をだんだん減らします(最大21日間内服していただきます)。 |
デュロキセチンの1日2回分割投与につきましては、添付文書とは異なる使用方法でありますが、1日2回分割投与の方が副作用が少ない可能性もある(少なくとも同程度である)という報告も海外から出ております。
治療の安全性と有効性を確認するため、次のようなスケジュールで検査を受けていただいたり、日誌の記入を行っていただきます。
| 登録時 | 1日目~13日目 | 14日目 | |
|---|---|---|---|
| 適格性・背景情報の確認(採血・問診等) | ○ | ||
| 服薬(朝・就寝時) | ○(毎日) | ○ | |
| 日誌の記入※1 | ○(毎日) | ○ | |
| レスキュー薬2の回数と量 | ○ | ○(毎日) | ○ |
| 肝機能・腎機能の確認(採血) | ○ |
※1 日誌には下記が含まれます。
| 毎日記入(最大21日間) | この24時間の最悪の痛みと平均した痛み、副作用と考えられる症状(ある場合のみ) |
| 1日目に記入 | 痛みの改善予測 |
| 1日目と14日目に記入 | 上記以外の痛み、生活の質(QOL)質問票 |
| 4日目・8日目・14日目に記入 | 痛みの変化についての全般的印象 |
※2 レスキュー薬:レスキュー薬とは通常の痛みの治療を行っていても、痛いときに内服する頓服(とんぷく)薬のことです。
この臨床試験に参加して受ける治療による利益はありませんが、計画された定期的な痛みや副作用のモニタリング、関連する専門機関の臨床医との追加的な連絡といった利益が想定されます。なお、この臨床試験に参加することによる、ご自身への経済的な利益はありません。
ただし、通常の薬物療法と同様、副作用などが生じる可能性があります(研究説明時にご説明させていただきます)。
薬剤に臨床的な利点があるかどうかを決定するための評価は第14日に行います。その後、用量を初回投与量まで段階的に減量し中止します(最大第21日目までかかります)。その後は、薬剤が奏効している場合、無効(効果不十分)な場合、減量中に再増悪した場合のいずれの場合も、担当の医師が、患者さんにとって最善の方法で治療を行います。
この試験が終了した後の治療については、担当の医師が、患者さんにとって最善の方法で治療を行います。
神経障害性疼痛の薬物治療には、オピオイド、鎮痛補助薬(本試験でも用いる抗うつ薬、抗けいれん薬など含む)が用いられることがありますが、その効果・安全性については科学的根拠が立証されていない部分も多々あり、本研究が必要な理由のひとつでもあります。そのなかで、担当の医師は、これらの治療法を考慮し、患者さんにとって最善の方法で治療を行います。
本試験は、2020年1月 から開始され、2022年9月 に終了する予定です(日本での登録) 。患者さんがこの試験に参加していただくのは14日(最長21日)となります。
予定参加人数は、プレガバリンを投与する患者さん80人、デュロキセチンを投与する患者さん80人 に参加をしていただく予定にしています。日本から100名、オーストラリアから60名の参加を予定しております。
参加の同意をいただいた後でも、患者さんの体の状態に変化があった場合や参加条件に合わないことが判明した場合には本治療を行わないことがあります。また、患者さんが何らかの理由によってこの治療を受けたくないと感じられた場合にもこの臨床試験を中止することができます。
痛いときは、いつもの通りにレスキュー薬(レスキュー薬とは通常の痛みの治療を行っていても、痛いときに内服する頓服薬のことです)を内服いただいて結構です。
試験期間中の薬剤の費用は研究費で負担しますので、患者さんに費用を請求することはありません。検査等そのほかの診療は全て保険診療の範囲内で行われます。この保険診療分については、通常の診療と同様に、診療にかかる医療費のうち健康保険からの給付をのぞく部分は患者さんの負担になります。また、この臨床試験参加に伴い、謝礼や交通費などをお支払いすることはありません。
本試験に使用する薬剤は、重篤な有害事象が起きる可能性は極めて低い、通常の痛み診療で使用されているものです。ただ万一、この臨床試験の参加中または終了後に、試験に参加したことが原因となって、予測しなかった重い副作用などの健康被害を受けた場合や、本試験に起因して、患者さんに万が一、死亡や後遺障害が生じた場合は、契約した保険によって補償を行います。
これまで説明しました内容以外で、患者さんがこの試験を続けるかどうかの判断に影響を与えるような情報(新たに判明した重大な副作用情報など)が得られた場合は、速やかに患者さんにお伝えします。その際は、あらためて試験への参加、または継続について、患者さんの意思を確認させていただきます。
研究に利用するデータには個人情報が含まれますが、院外に提出する場合には、お名前、住所など、個人を直ちに判別できる情報は削除し、研究用の番号を付けます。研究用の番号と患者さんの名前を結び付ける対応表は各施設の個人情報保護責任者が作成し、適切に管理いたします。
また、この試験が正しく行われているかを確認するために、この臨床試験の関係者(参加施設の職員、モニタリング担当者、監査担当者、臨床研究審査委員会、厚生労働省の関係者、この試験の研究事務局担当者など)が患者さんのカルテなどの医療記録を見ることがあります。しかし、患者さんから得られたデータが、報告書などで患者さんのデータであると特定されることはありませんし、個人情報の守秘義務など、患者さんの人権の擁護には万全を期しています。
なお、患者さんから得られたデータは、研究終了後5年間は各施設にて保管いたします。廃棄時にはプライバシーの流出に最大限の配慮のもと適切に処分いたします。
ご希望があれば、個人情報の保護や研究の独創性の確保に支障がない範囲内で、この臨床試験の実施計画書や研究の方法に関する資料を入手または閲覧することができますので、お申し出ください。
この臨床試験の概要や結果は、jRCT(Japan Registry of Clinical Trials)の臨床研究実施計画・研究概要公開システムに登録されます。このシステムは、インターネット上で誰でも閲覧することができますが、参加された患者さんの個人情報が公表されることは一切ありません。
この試験で得られた成績は、学会や医学雑誌などに公表されることがありますが、発表に際し、患者さんの名前などの個人的情報は一切わからないようにします。
そして、個人識別情報とリンクしない形でデータを二次利用することがあり得ます。いずれの場合もプライバシーの保護には万全を期しています。今後、新たな研究への利用目的が特定された場合には、新たに研究計画書を作成または改訂し、臨床研究審査委員会の承認を受けます。その際には、患者さんにも新たな研究についての情報を公開させていただきます。公開された情報をみて同意を撤回いただくことも可能です。
本試験は、国立研究開発法人日本医療研究開発機構研究費「革新的がん医療実用化研究事業」の資金を用いて実施しています。この試験の実施や報告の際に、金銭的な利益やそれ以外の個人的な利益のために結果がゆがめられることは一切ありません。また、試験薬の企業と本試験研究者の個人的な関係なども一切ありません。ご不明な点などありましたら、いつでもご連絡ください。
| 研究課題名 | オピオイド不応性がん関連神経障害性疼痛を対象に14日間のデュロキセチンの有効性および安全性をプレガバリンと比較する国際多施設共同二重盲検用量漸増 第III相ランダム化比較試験 |
|---|---|
| 研究責任者 /研究事務局 |
松岡 弘道 国立がん研究センター中央病院 緩和ケアチーム / 精神腫瘍科 科長 |
| 研究参加施設 |
|
| 研究分担医師 |
|
| 共同研究者 |
|
| データ センター |
NPO法人JORTC データセンター 〒116-0013 東京都荒川区西日暮里2-54-6-302 TEL: 03-5604-9850 |
[最終更新日]2021年 3月 8日
オピオイド不応性がん関連神経障害性疼痛を対象に
14日間のデュロキセチンの有効性および安全性をプレガバリンと比較する
国際多施設共同二重盲検用量漸増 第III相ランダム化比較試験
[運営事務局]
国立がん研究センター中央病院
緩和ケアチーム / 緩和医療科・精神腫瘍科
〒104-0045 東京都中央区築地5-1-1
03-3542-2511(代表)
Copyright © 2021-2022. depart-pain.jp . All Rights Reserved Worldwide.